Получение оксидов
Общие методы получения оксидов:.
1. простые взаимодействия вещества с кислородом:.
1. 1. окисление металлов: большинство металлов окисляются из оксидов при фиксированных условиях окисления.
Например, алюминий реагирует с кислородом с образованием оксидов.
Золото, платина и палладий не реагируют с кислородом.
Натрий образует в основном пероксид Na2O2,
Калий, калий и рубид образуют в основном синтетические пероксиды МпО2:
Примечание: Металлы с переменной степенью окисления обычно окисляются в промежуточной степени окисления (+3).
Железо также сгорает с образованием накипи железо — железо — железо (II, III).
1. 2 Окисление простых неметаллических веществ.
Как правило, при окислении неметаллических веществ образуются неметаллические оксиды с высшей степенью окисления при наличии избытка кислорода или, в отсутствие кислорода, неметаллические оксиды с избытком кислорода или промежуточной степенью окисления.
Например, фосфор окисляется при избытке кислорода в оксид фосфора (V) и при недостатке кислорода в оксид фосфора (III).
Однако есть и исключения.
Например, сера сгорает только в оксиде серы (IV).
Оксид серы (VI) получается только при окислении оксида серы (IV) в жестких условиях в присутствии катализатора.
2SO2 + O2= 2SO3
Азот окисляется кислородом только при очень высоких температурах (около 2000 o C) или под воздействием силового разряда и только с образованием оксида азота (II).
Фторид F не окисляется кислородом2(сам фтор окисляется кислородом). Другие галогены (хлор закрытый)2Другие галогены (хлор CL, бром и т.д.) и благородные (ад, неон, слон, крипто) не реагируют с кислородом.
2. окисление сложных веществ (бинарных соединений): например, сульфидов, гидратов, фосфоров.
При окислении кислородом сложных веществ, обычно состоящих из двух элементов, при определенных условиях окисления образуется смесь оксидов этих элементов.
Например, при сгорании пилотов ФЭС2образует оксид железа (III) и оксид серы (IV).
При сгорании водорода в присутствии избытка кислорода образуется оксид серы (IV), а в отсутствие кислорода — сера.
Аммиак, с другой стороны, горит с образованием простого вещества n. n2поскольку азот реагирует с кислородом только в сложных условиях: n
Однако в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):.
3. разложение гидроксида. Оксиды могут также образовываться под действием гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и их нужно нагревать (сжигать), чтобы разложить другие гидроксиды (обычно нерастворимые) гидроксиды, которые естественным образом растворяются в оксидах и воде.
Гидроксид → оксид + вода
Углекислота, серная кислота, гидроксид аммония, гидроксид серебра (I) и меди (I) самопроизвольно разлагаются в водных растворах.
2AGOH → AG2O + H2O
2Cuoh → Cu2O + H2O
При нагревании большинство нерастворимых гидроксидов разлагаются на оксиды — кремниевую кислоту, гидроксиды тяжелых металлов — гидроксид железа (III) и т.д.:.
4. Другим способом получения оксидов является разложение комплексных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании распадаются на оксиды.
Соли, образованные сильными окислительными кислотами (например, нитраты, сульфиты, высокие хлоры), обычно распадаются, изменяя свою степень окисления при нагревании: нагревание
Подробнее о расщеплении нитратов читайте в статье.
Химические свойства оксидов
Многие из химических свойств оксидов иллюстрируются диаграммами взаимосвязей для основных категорий неорганических веществ.
Ход урока
Ι. Изучение нового материала
организация деятельности по решению проблем. Работа в группах.
Группа 1 (Оксиды. Сортировка. Номенклатура) работают с.
1) С помощью коллекции оксидов в таблице, статья «Физические свойства оксидов» стр. 218 опишите их физические свойства и отметьте состояние накопления и цвет. Вывод. Попытайтесь объяснить это разнообразие.
Предполагаемые ответы: изучение представленных оксидов показало, что это: твердая медь (П) Куо, Цао оксид кальция, оксид серы (VI)3и газообразный оксид углерода (IV) Co2. Их цвета также сильно различаются: Cuo — черный, оксид кальция Cao — белый, оксид углерода (IV) co — бесцветный.2 — бесцветен. Можно предположить, что причина кроется в различной структуре этих оксидов.
2) Выберите из каталога слов ключевые слова, характеризующие оксид: простое вещество, сложное вещество, летучий, бесцветный, цветной, бинарное соединение, включающее кислород, неминеральный, металл.
Сформулируйте определение оксида на основе ключевых слов. Напишите его. Проверьте учебник с. 91.
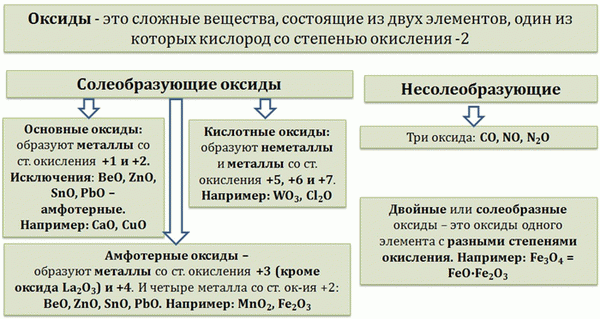
3) Сортировка. Определите свойства, позволяющие разделить оксиды на группы.
I. В зависимости от того, какой предмет, образованный оксидом, является металлическим или неметаллическим:.
(а) оксиды металлов — (б) оксиды неметаллов.
II. в зависимости от способности образовывать определенные классы гидроксидов: основания (щелочи), кислоты.
(а) основные оксиды — (б) кислотные оксиды.
II. в зависимости от их химических свойств:.
(а) не образуют солей; (б) образуют соли.
4) Номенклатура. Работа с книгой. Учебник стр. 89-90 Пользуясь инструкцией, назовите предложенные оксиды. Сформулируйте правила присвоения названий оксидам.
Группа 2: Работа.
1) Свойства кислотных оксидов.
Углерод (c) → оксид углерода (co2) → карбоновая кислота (h2CO3) → карбонат кальция (Caco3) → силикат кальция (Caco)3).
Сделайте выводы о химических свойствах кислотных оксидов; проверьте свои выводы по данным учебника на стр. 220. 220.
2) Свойства основных оксидов.
Сообщите о химических свойствах основных оксидов. Проверьте свои выводы и сравните их с данными учебника на стр. 220.219.
Работайте в группах 3.
1) Получите оксиды.
(b) Создайте ал.2O3, со.3и CAO с разложением объединенного вещества.
Сделайте выводы о способе получения оксида.
Предполагаемый ответ: оксиды образуются следующим образом:.
1) При сжигании простых и сложных веществ.
2) при разделении сложных веществ: а) нерастворимых оснований, б) кислот, в) солей.
Группа 4 работает следующим образом.
1) Докажите или опровергните утверждение:.
- Песок не имеет промышленного применения.
- Углекислый газ является продуктом фотосинтеза.
- Руда Fe состоит из оксидов железа2O3и Fe3O4Чугун и сталь изготавливают из руд оксидов железа.
ΙΙ. Закрепление знаний, умений, навыков
Выполните самооценку в соответствии с вариантом:.
Вариант i.
(1) Оксид кальция реагирует с НС1, NAOH и Н в следующих соединениях, которые представляют следующие типы.2O, H2SO4Naoi, H и KC1; приведите уравнения возможных реакций.
(2) Составьте типы оснований, соответствующие оксидам натрия, кальция, алюминия и магния.
Выбор 2
(1) Из перечисленных ниже веществ следующие типы реагируют с оксидом серы (VI): НС1, NAOH, H2O, CA(OH)2и KC1; приведите уравнения возможных реакций.
(2) Укажите типы кислот, соответствующие оксидам серы (VI), фосфора (V), азота (V) и углерода (IV).
Вариант 3 (экспериментальный).
Работа I. Как было установлено, что оксид бария является основным оксидом?
Обсуждение решения экспериментальной задачи. Ученик проводит эксперимент за столом, растворяя оксид бария в воде и обнаруживая образовавшуюся щелочь по индексу. Другой ученик растворяет оксид бария в соляной (HCl) кислоте, которая предварительно «окрасилась» в луже. Затем учащиеся составляют уравнение реакции.
